
-
 China kritisiert und droht EU wegen Brüsseler Vorgehen gegen Windturbinenhersteller
China kritisiert und droht EU wegen Brüsseler Vorgehen gegen Windturbinenhersteller
-
WM-Debatte: EU-Abgeordnete mit Appell an UEFA

-
 Baden-Württemberg: 23-Jähriger stirbt bei Zusammenstoß von Auto und Zug
Baden-Württemberg: 23-Jähriger stirbt bei Zusammenstoß von Auto und Zug
-
Wieder Schnee und überfrierender Regen: Behinderungen und Unfälle im Nordwesten

-
 Umfrage: Unternehmen in deutscher Autoindustrie erwarten mehr Exporte
Umfrage: Unternehmen in deutscher Autoindustrie erwarten mehr Exporte
-
Mörder von Japans Ex-Regierungschef Abe legt Berufung gegen Haftstrafe ein

-
 Litauen-Brigade nimmt Form an: Staatssekretär Hartmann bei Aufnahme von Bundeswehr-Soldaten
Litauen-Brigade nimmt Form an: Staatssekretär Hartmann bei Aufnahme von Bundeswehr-Soldaten
-
NHL: Niederlagen für Draisaitl und Co.

-
 NBA: Hartenstein mit erstem Triple-Double im deutschen Duell
NBA: Hartenstein mit erstem Triple-Double im deutschen Duell
-
Washington erneuert Handelsabkommen mit afrikanischen Ländern bis Ende des Jahres

-
 Human Rights Watch zeichnet düsteres Bild bei Menschenrechten
Human Rights Watch zeichnet düsteres Bild bei Menschenrechten
-
Pistorius nach Start von Fragebogenaktion zuversichtlich für Verzicht auf Wehrpflicht

-
 Schlechte Bayern-Phase? Tah winkt ab
Schlechte Bayern-Phase? Tah winkt ab
-
Musiala: "Ich lebe wieder"

-
 Legende Maier von Diskussionen um Neuer genervt
Legende Maier von Diskussionen um Neuer genervt
-
Epstein-Affäre: Trump will das Thema abhaken

-
 Umfrage: Vier von Fünf finden Vorsorge wichtig – doch nur jeder Zweite geht hin
Umfrage: Vier von Fünf finden Vorsorge wichtig – doch nur jeder Zweite geht hin
-
Telekom eröffnet mit Nvidia ausgebautes KI-Rechenzentrum in München

-
 Angriff auf Neonazis in Ungarn: Urteil gegen Maja T. in Budapest erwartet
Angriff auf Neonazis in Ungarn: Urteil gegen Maja T. in Budapest erwartet
-
Litauen-Brigade nimmt Form an: Pistorius bei Aufnahme von Bundeswehr-Soldaten

-
 Ukraine-Krieg: Neue Gesprächsrunde zwischen Kiew und Moskau in Abu Dhabi
Ukraine-Krieg: Neue Gesprächsrunde zwischen Kiew und Moskau in Abu Dhabi
-
Bundeskanzler Merz reist in die Golfregion

-
 US-Football-Liga NFL: Keine ICE-Einsätze beim Super Bowl am Sonntag geplant
US-Football-Liga NFL: Keine ICE-Einsätze beim Super Bowl am Sonntag geplant
-
Gesetzlich Versicherte müssen im Schnitt 42 Tage auf Facharzttermin warten
-
 Trump ruft Putin zu Beendigung des Krieges in der Ukraine auf
Trump ruft Putin zu Beendigung des Krieges in der Ukraine auf
-
Trump und Kolumbiens Präsident Petro loben Treffen im Weißen Haus

-
 Gazastreifen: Netanjahu schließt Beteiligung von Palästinenserbehörde an Verwaltung aus
Gazastreifen: Netanjahu schließt Beteiligung von Palästinenserbehörde an Verwaltung aus
-
Havertz trifft spät: Arsenal im League-Cup-Finale

-
 "Shutdown" in den USA beendet: Trump unterzeichnet Haushaltsgesetz
"Shutdown" in den USA beendet: Trump unterzeichnet Haushaltsgesetz
-
Halbfinal-Hattrick perfekt: Bayers Pokaltraum lebt

-
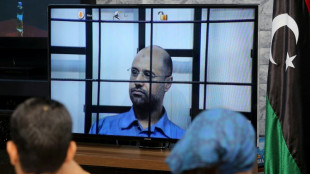 Berater: Gaddafi-Sohn Seif al-Islam in seinem Haus in Libyen getötet
Berater: Gaddafi-Sohn Seif al-Islam in seinem Haus in Libyen getötet
-
Ehepaar Clinton soll Ende Februar in Epstein-Affäre vor US-Kongress aussagen

-
 US-Repräsentantenhaus ebnet Weg für "Shutdown"-Ende
US-Repräsentantenhaus ebnet Weg für "Shutdown"-Ende
-
Vier Jahre Haft und fünf Jahre Kandidaturverbot für Le Pen gefordert

-
 Null Grad und Frost: Historischer Temperatursturz in Karibikstaat Kuba
Null Grad und Frost: Historischer Temperatursturz in Karibikstaat Kuba
-
Schenderlein zu WM-Boykott: "Das unterstützen wir nicht"

-
 Le-Pen-Prozess: Vier Jahre Haft und fünf Jahre Kandidaturverbot gefordert
Le-Pen-Prozess: Vier Jahre Haft und fünf Jahre Kandidaturverbot gefordert
-
USA schießen iranische Drohne nahe Flugzeugträger im Arabischen Meer ab

-
 EU-Kommission weist neue "Zensur"-Vorwürfe aus Washington scharf zurück
EU-Kommission weist neue "Zensur"-Vorwürfe aus Washington scharf zurück
-
Nach Anfeindungen: Trump empfängt Kolumbiens Präsidenten Petro

-
 Gemeinde Crans-Montana spendet über eine Million Euro für Opfer der Brandkatastrophe
Gemeinde Crans-Montana spendet über eine Million Euro für Opfer der Brandkatastrophe
-
Nato hat mit Planung für Arktis-Mission "Arctic Sentry" begonnen

-
 Unwetterwarnungen in Spanien und Portugal wegen Sturm "Leonardo"
Unwetterwarnungen in Spanien und Portugal wegen Sturm "Leonardo"
-
Epstein-Skandal: Britischer Ex-Botschafter Mandelson gibt Sitz im Oberhaus ab

-
 Ski-Star Kilde verzichtet auf Olympiastart
Ski-Star Kilde verzichtet auf Olympiastart
-
Steigende Armutsgefährdung: Forderungen nach Stärkung des Sozialstaat

-
 Trotz Kreuzbandriss: Vonn will bei Olympia starten
Trotz Kreuzbandriss: Vonn will bei Olympia starten
-
Bund will mit milliardenschwerem Tennet-Einstieg Ausbau der Stromnetze absichern

-
 Riera hat klare Vorstellungen: "Ich glaube an meine Ideen"
Riera hat klare Vorstellungen: "Ich glaube an meine Ideen"
-
Französische Justiz will X-Eigentümer Musk anhören - Durchsuchungen in Büros


BioNxt Solutions berichtet über Fortschritte in der Entwicklung von BNT23001 für die Behandlung der Multiplen Sklerose
BioNxt Solutions Inc. („BioNxt" oder das „Unternehmen") (CSE: BNXT / OTC: BNXTF / FWB: BXT), ein auf fortschrittliche Arzneimittelverabreichungssysteme spezialisiertes Biowissenschaftsunternehmen, hat in der Entwicklung von BNT23001, seiner proprietären sublingualen Schmelzfilm-(OFD)-Formulierung von Cladribin für die Behandlung der Multiplen Sklerose (MS), entscheidende Meilensteine erzielt. Diese Erfolge im Jahr 2024 schaffen die Grundlage für klinische Prüfungen und Zulassungsanträge im Jahr 2025 und bestärken BioNxt darin, sich auch weiterhin intensiv für patientenzentrierte Therapielösungen einzusetzen.
Meilensteine 2024: Schaffung einer soliden Grundlage für die Entwicklung des Cladribin-Schmelzfilms
Präklinischer Erfolg: Dank der sublingualen Verabreichung konnten mit BNT23001 in pharmakokinetischen (PK) Studien an Tiermodellen hohe Resorptionsraten von Cladribin erreicht werden. Diese Studien haben die Bioäquivalenz des Produkts mit dem Originalpräparat Mavenclad® bestätigt und die rasche Resorption und das Sicherheitsprofil des Schmelzfilms validiert. Darüber hinaus wurden in Toxizitätsstudien keine nachteiligen lokalen Effekte beobachtet, was die Machbarkeit des Ansatzes der sublingualen Verabreichung unterstreicht.
Fortschritte bei der Herstellung: BioNxt hat die Herstellung von BNT23001 erfolgreich auf seinen GMP-zertifizierten Produktionspartner, die Gen-Plus GmbH & Co KG in München (Deutschland), übertragen und damit die Produktreife für die klinische Chargenproduktion sichergestellt. Dieser Meilenstein unterstützt das Unternehmen bei der geplanten Einleitung der klinischen Prüfungen im Jahr 2025 mit einer zuverlässigen und qualitativ hochwertigen Produktversorgung.
Gestärkte Position im Bereich des geistigen Eigentums: Ein positiver internationaler vorläufiger Bericht zur Patentfähigkeit (IPRP) bestätigt die Neuheit, die erfinderische Tätigkeit und die industrielle Anwendbarkeit von BNT23001 und unterstreicht damit den einzigartigen Wert des Produkts für die Behandlung von MS. Das Unternehmen hat in wichtigen Rechtssystemen wie Europa, den Vereinigten Staaten und Kanada die nationale Phase beim Patentschutz eingeleitet; in mehreren Regionen ist bis Mitte 2025 mit der Erteilung der Patente zu rechnen.
Roadmap 2025: Weiterentwicklung von BNT23001 in Richtung klinischer Prüfungen
Herstellung klinischer Chargen: BioNxt wird im zweiten Quartal 2025 die GMP-Herstellung und die Freigabe der Chargen für klinische Prüfungen durch einen qualifizierten Sachverständigen (Qualified Person, QP) abschließen. Dieser Schritt ist entscheidend für die erfolgreiche Einleitung von Humanstudien.
Zulassungsanträge und Genehmigungen: Das Unternehmen plant, die Unterlagen für das Prüfpräparat (Investigational Medicinal Product Dossier, IMPD) bis Mitte 2025 bei den europäischen Zulassungsbehörden einzureichen und damit den Weg für die Genehmigung klinischer Prüfungen zu ebnen. Diese Zulassungsanträge werden Daten aus präklinischen Studien und Stabilitätsbewertungen enthalten, die am Produktionsstandort durchgeführt werden.
Klinische Studie zur Leistungsvalidierung: BioNxt hat die Absicht, in der zweiten Jahreshälfte 2025 eine klinische Pilotstudie zu starten. Diese Vergleichsstudie zur Wirksamkeit, Bioverfügbarkeit und Sicherheit von BNT23001 gegenüber Mavenclad®, dem Originalprodukt in Tablettenform, soll die Schmelzfilmformulierung als patientenfreundliche Alternative positionieren.
Laufende Maßnahmen beim Patentschutz: BioNxt fährt mit den Antragstellungen bei den nationalen Patentämtern fort und rechnet damit, dass die erteilten Patente in den jeweiligen Schlüsselregionen seine Immaterialgüterrechte stärken und Wettbewerbsvorteile auf dem Weg zur Markteinführung des Produkts bringen werden.
BNT23001: Fortschritte in Richtung klinischer Validierung für die Behandlung von MS
BNT23001 bietet einen neuartigen Ansatz in der Behandlung von MS, mit dem die Grenzen der traditionellen oralen Therapien überwunden werden. Der sublinguale Schmelzfilm überzeugt mit folgenden Vorteilen:
Bequeme Handhabung: Einfach in der Anwendung und tragbar, ideal für Patienten mit Schluckbeschwerden oder einem aktiven Lebensstil.
Rasche Resorption: Mit der direkten Verabreichung über die sublinguale Schleimhaut wird eine schnellere therapeutische Wirkung erzielt.
Verbesserte Compliance: Die patientenfreundliche Alternative soll die Einhaltung des verordneten Therapieschemas erleichtern.
Dank dieser Vorteile erfüllt BNT23001 auch den Anspruch von BioNxt, den Therapieerfolg bei Patienten mit chronischen Krankheiten wie MS zu verbessern.
Über BioNxt Solutions Inc.
BioNxt Solutions Inc. ist ein innovatives Biowissenschaftsunternehmen, das sich auf Arzneimittelverabreichungstechnologien der nächsten Generation, diagnostische Screening-Systeme und die Entwicklung aktiver pharmazeutischer Wirkstoffe konzentriert. Die firmeneigenen Plattformen - Sublingual (Schmelzfilm), Transdermal (Hautpflaster) und Oral (magensaftresistente Tabletten) - zielen auf wichtige therapeutische Bereiche ab, zu denen Autoimmunerkrankungen, neurologische Erkrankungen und Langlebigkeit zählen.
Mit seinen Forschungs- und Entwicklungsaktivitäten in Nordamerika und Europa erzielt BioNxt entsprechende Fortschritte bei den behördlichen Zulassungsverfahren und Vermarktungsinitiativen, wobei der Fokus in erster Linie auf den europäischen Märkten liegt. BioNxt hat sich zum Ziel gesetzt, die Gesundheitsversorgung durch die Bereitstellung von präzisen, patientenzentrierten Lösungen zu verbessern, mit denen man weltweit größere Behandlungserfolge erzielen will.
BioNxt notiert an der Canadian Securities Exchange (BNXT), im OTC-Markt (BNXTF) und in Deutschland (WKN: A3D1K3). Nähere Informationen zu BioNxt erhalten Sie unter www.bionxt.com.
Kontakt für Investoren & Medien
Hugh Rogers, Mitbegründer, CEO und Direktor
E-Mail: [email protected]
Tel.: +1 780-818-6422
Web: www.bionxt.com
LinkedIn: https://www.linkedin.com/company/bionxt-solutions
Instagram: https://www.instagram.com/bionxt
Vorsorglicher Hinweis bezüglich „zukunftsgerichteter" Informationen
Diese Pressemitteilung enthält zukunftsgerichtete Aussagen im Sinne der geltenden Wertpapiergesetze, einschließlich Aussagen zur Entwicklung, Prüfung, behördlichen Zulassung und Vermarktung von BNT23001 sowie zu den geplanten Meilensteinen für 2025. Diese Aussagen beruhen auf aktuellen Erwartungen und Annahmen, beinhalten jedoch Risiken und Ungewissheiten, die dazu führen können, dass die tatsächlichen Ergebnisse erheblich abweichen. Zu diesen Risiken gehören die Ergebnisse klinischer Studien, Verzögerungen bei der Zulassung, Herausforderungen bei der Herstellung, Fragen des geistigen Konzessionsgebiets, der Wettbewerb auf dem Markt sowie Änderungen der Gesetze oder der Marktbedingungen. Das Unternehmen ist nicht verpflichtet, zukunftsgerichtete Aussagen zu aktualisieren oder zu überarbeiten, es sei denn, dies ist gesetzlich vorgeschrieben. Weitere Informationen finden Sie im Abschnitt „Risikofaktoren" in den Unterlagen des Unternehmens unter www.sedarplus.ca.
Handelsmarken: Mavenclad® ist eine eingetragene Marke von EMD Serono, Inc. BioNxt Solutions Inc. ist weder mit EMD Serono verbunden noch wird es von EMD Serono unterstützt.
QUELLE: BioNxt Solutions Inc.
Die Ausgangssprache (in der Regel Englisch), in der der Originaltext veröffentlicht wird, ist die offizielle, autorisierte und rechtsgültige Version. Diese Übersetzung wird zur besseren Verständigung mitgeliefert. Die deutschsprachige Fassung kann gekürzt oder zusammengefasst sein. Es wird keine Verantwortung oder Haftung für den Inhalt, die Richtigkeit, die Angemessenheit oder die Genauigkeit dieser Übersetzung übernommen. Aus Sicht des Übersetzers stellt die Meldung keine Kauf- oder Verkaufsempfehlung dar! Bitte beachten Sie die englische Originalmeldung auf www.sedarplus.ca, www.sec.gov, www.asx.com.au/ oder auf der Firmenwebsite!
M.Carneiro--PC



